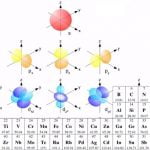
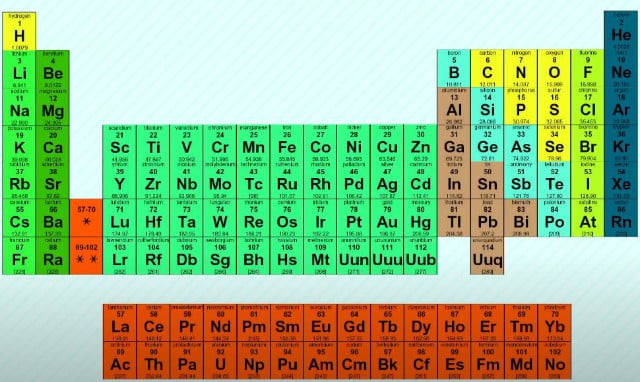
En la tabla periódica de Mendeleiev los elementos químicos están dispuestos en orden de aumento del número atómico; sus propiedades químicas se colocan en un determinado esquema.
Al Ruso químico, Dmitry Mendeleiev le gustaba decir que la idea de un sistema periódico le llegó en un sueño. Al igual que muchos químicos a mediados del siglo XIX, trató de organizar de alguna manera un gran número de elementos químicos descubiertos. Mendeleiev estaba trabajando en el libro «Fundamentos de la Química» en ese momento, y siempre le pareció que para las sustancias que describió; sin duda debe haber alguna manera de ordenar que los haría más que un conjunto aleatorio de elementos. Esta es la forma de ordenar, tal ley que vio en su sueño. En su tabla que hoy conocemos como tabla periódica o también sistema de elementos periódicos.
Mendeleiev colocó los elementos químicos en filas con el fin de aumentar su masa; seleccionando la longitud de las filas para que los elementos químicos de una columna tuvieran propiedades químicas similares. Por ejemplo, la columna extrema derecha de la tabla contiene helio, neón, argón, krypton, xenón y radón. Se trata de gases nobles, sustancias que son reacias a reaccionar con otros elementos y exhiben baja actividad química. Por el contrario, los elementos de la columna izquierda están el litio, sodio, potasio y otros; que reaccionan con otras sustancias químicas violentamente, el proceso es explosivo. Se pueden hacer instrucciones similares sobre las propiedades químicas de los elementos de otras columnas de tabla; dentro de la columna estas propiedades son similares, pero varían a medida que se mueve de una columna a otra.
Reconocimiento a Mendeleiev por su tabla periódica
Es imposible no rendir homenaje al valor del pensamiento de Mendeleiev, que decidió publicar sus resultados. Por un lado, la tabla en su forma original contenía muchas celdas vacías. Los elementos de los que ahora sabemos aún no habían sido descubiertos. De hecho, el descubrimiento de estos elementos, incluyendo el escandio y el germanio, fue uno de los mayores triunfos del sistema periódico. Por otro lado, Mendeleiev tuvo que admitir que los pesos atómicos de algunos elementos fueron mal juzgados; porque de lo contrario no encajarían todos en el sistema. Una vez más, resultó que tenía razón. El sistema periódico en su primera versión simplemente reflejaba la situación actual en la naturaleza.
Al igual que con las leyes Kepler del movimiento planetario, la tabla periódica o sistema periódico de Mendeleiev no explicó por qué debería ser así. Fue sólo con el advenimiento de la mecánica cuántica y, en particular; el principio de la prohibición de Pauli que el verdadero significado de la disposición de los elementos en la tabla periódica se hizo evidente. Hoy nos fijamos en la tabla periódica en términos de cómo los electrones llenan las órbitas de electrones en el átomo (ver el Principio de Aufbau). Las propiedades químicas del átomo para saber qué tipo de enlaces se formarán con otros átomos están determinadas por el número de electrones en la capa externa.
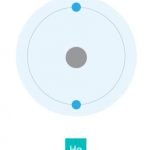
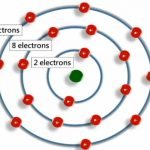
Por lo tanto, el hidrógeno y el litio sólo tienen un electrón externo, por lo que en las reacciones químicas se comportan de manera similar. A su vez, tanto el helio como el neón han llenado las órbitas externas; y también se comportan de manera similar, pero completamente diferentes del hidrógeno y el litio. Los elementos químicos hasta el uranio (contiene 92 protones y 92 electrones) se encuentran en la naturaleza. A partir del número 93 hay elementos artificiales creados en el laboratorio. Hasta ahora, el mayor número declarado por los científicos es de 118 el máximo.